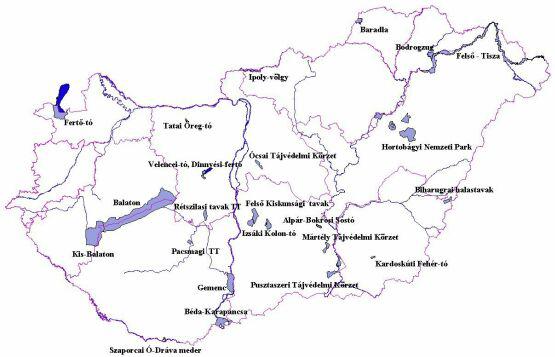
Vízi és vizes élőhelyek, hidrobiológiai hatások
A klímaváltozás általános hatásai a vízi ökoszisztémákra
A vízi ökológiai rendszerek a sajátos közeg, fizikai és kémiai jellemzők, illetve sajátos táplálékhálózataik és funkciós csoportjaik folytán a szárazföldi ökoszisztémáktól eltérő változásokon mennek keresztül a globális felmelegedés hatására. Emiatt mindenképp indokolt, hogy külön figyelmet szenteljünk nekik.
A klímaváltozás talán a legszembetűnőbb módon a sarkvidéki óceánokat érinti, ahol a hőmérséklet és az aciditás a globális átlaghoz képest kétszeres ütemben nő. A nyári jégborítás 2037-re teljesen megszűnik majd az északi sarkvidéki tengereken. Ezáltal egyes habitatok végleg eltűnnek. Hasonlóan a korallzátonyok, tengerifű mezők és mangrovék a klímaváltozáshoz köthető, erőteljes visszaszorulásához (Hoegh-Guldberg és Bruno 2010). Ezen folyamatok a habitatok diverzitásának csökkenését, egyes fajok kihalását eredményezik.
Számos példával alátámasztható, hogy a vízi életközösségek kimondottan érzékenyek a klímaváltozásra, hamarabb és intenzívebben reagálnak, mint a legtöbb szárazföldi életközösség (Battarbee 2000, Sipkay et al (2008, 2009, 2012), Vadadi-Fülöp Cs et al. (2008, 2009, 2012)). A tengeri zooplanktonban zajló változások drámai sebességgel mennek végbe: az északkeleti Atlanti-óceán copepoda közösségei évtizedenként 260 km-rel vándoroltak északabbra, a Centropages chierchiae és a Temora stylifera Calanoida (Copepoda) fajok esetében ez a sebesség 157 km / évtized. Összehasonlítás képpen: egy 99 madár-, lepke- és lágyszárú fajt vizsgáló metaanalízis 6,1 km-es area eltolódást állapított meg évtizedenként. A plankton élőlényeinek fenológiája is rendkívül érzékenyen, nagy időbeli eltolódásokkal válaszol a klímaváltozásra. Egy tanulmány 172 növény, lepke, puhatestű, madár és kétéltű fenológiáját vizsgálva, évtizedenként 3-6 napos eltolódást állapított meg; a zooplankton esetében átlagosan 7,6 nap/évtized az eltolódás mértéke (Richardson 2008).
A vízi ökoszisztémák klímaváltozásra adott válaszában ezidáig három általános érvényű szabályt sikerült felfedezni, melyek közül az első kettő mindenképp érvényes a szárazföldön is.
- Az areák eltolódása a magasabb szélességek vagy a tengerszint felett magasabban fekvő területek felé.
- A fenológiai mintázatok megváltozása.
- Az átlagos testméret csökkenése, mind a közösség, mind a funkciós csoportok, mind pedig az egyes populációk szintjén (Montoya és Raffaelli 2010, Daufresne et al. 2009).
A légköri CO2 -szint emelkedés közvetlen hatása a tengeri ökoszisztémákra
Napjainkban köztudott, hogy a légköri CO2 nagy mértékben felelőssé tehető Földünk megnövekedett hőmérsékletéért, de kevésbé ismert az, hogy közvetlen hatással van a vízi ökoszisztémákra is. A légkörben található CO2 mennyisége mára elérte a 380 ppm-et. A mérések szerint ez az érték mintegy 80 ppm -mel meghaladja az elmúlt 740 000 évben mérhetőt (Petit et al. 1999).
A légkörbe kerülő CO2 mennyisége és a tengerek CO2 tartalma egyensúlyban áll egymással, az évi kibocsájtás 25%-a a vizekbe oldódik (Canadell et al. 2007). A bekerülő CO2 hidrogén karbonáttá és hidrogén ionná alakul, a felszabaduló hidrogén ion pedig a karbonátionokat lekötve csökkenti az olyan vázképző állatok kalcifikációjának sebességét, mint amilyen a korall is (Hoegh-Guldberg et al. 2007).
A folyamatot a 0,7 °C-kal megemelkedett vízhőmérséklet, a beoldódott CO2 következtében létrejött 0,1 pH emelkedés is tovább erősíti. A korallállatok a kisebb hatékonyságú vázképzést első lépésben úgy próbálják ellensúlyozni, hogy csökkentik a hosszirányú növekedési rátájukat, vázuk sűrűségét, valamint több energiát fektetnek a vázképzésbe, amit a szaporodási ráta és ellenálló képesség csökkentésével érnek el. Ennek a három jelenségnek következtében méretben kisebb, törékenyebb, újrakolonizálásra kevésbé képes korallszirteket kapunk.
A korallállatok a melegedést csak kis mértékben képesek elviselni, a velük szimbiózisban élő dinoflagelláták (Symbiodinium spp.) kilépnek a szimbiózisból, ha az nyári maximális vízhőmérséklet 1-2°C-kal 3-4 hétig meghaladja a megszokottat. A korallok képesek visszaszerezni szimbiontáikat, de csökkent kalcifikáló-, szaporodó-, betegségekkel szemben ellenálló és kompetíciós képességgel rendelkeznek, mint azelőtt. Ezáltal a korallok helyét idővel makroalgák vehetik át az ökoszisztémában, ami jelentős biodiverzitás csökkenést eredményez.
Ha a légköri CO2 mennyiség meghaladja az 500 ppm-et és ezzel együtt a felmelegedés a 3°C-ot, akkor a korallzátonyok teljes rendszere megsemmisülhet. A halállomány összeomlása mellett a zátonyok többé nem védenek a vihar rombolásától sem. Ennek katasztrofális következményeit a közvetlenül a halászatból és turizmusból élő, közel 10 000 000 ember tapasztalhatja majd meg. (Hoegh-Guldberg et al. 2007). A CO2gáz köztudottan üvegházhatást fokozza, amely bolygónk átlaghőmérsékletét növeli.
Folyók, tavak, tengerek, óceánok
Halfajok gyakran termikus guildekbe csoportosulnak (Rahel et al. 1996, Magnuson et al. 1979), a fajok elkülönülnek a fiziológiás és ökológiai optimumukban. A folyók hőmérsékletének emelkedése az elkövetkező években sok probléma forrása lehet. Az egyre melegedő vizek miatt a halfajok egyre északabbra és magasabbra szorulnak. A déli vizek hőmérséklet emelkedése melegkedvelő fajok visszaszorulását eredményezheti, mivel ezek sok esetben szűk tűrésűek. Az Egyesült Államok déli részének halfaunáját vizsgálva az derült ki, hogy a várható elterjedéscsökkenés 14,2% a melegkedvelő és 50% a hideg és hűvös vizeket preferáló halfajok esetében (Eaton et al, 1996). Egy másik vizsgálat tanulsága szerint a patakokban élő pisztrángok elterjedésbeli csökkenése akár a 7-76%-ot is elérheti (Rahel et al. 1996).
Meg kell említenünk azt, hogy az elterjedési terület csökkenésével párhuzamosan az élőhelyek fokozatosan, egyre nagyobb mértékben feldarabolódnak, az így fennmaradt fajok pedig sokkal sérülékenyebbek a klímaváltozás hatásaira (Schwartz et al. 2006). A planktonikus élet szempontjából fontos környezeti tényező a felszíni vízhőmérséklet. A déli féltekén előfordul két, az időjárást jelentősen befolyásoló jelenség, az El Niño és La Niña.
A La Niña (leánygyermek) a Csendes-óceán trópusi területeinek középső és keleti részén előforduló, a normálisnál hidegebb tengerfelszínt jelenti. La Niña idején a keleties passzátszelek megerősödnek, és Dél-Amerika nyugati partjainál a hideg víz intenzívebben áramlik fel. A tengerfelszín hőmérséklete 4°C-kal az átlagos alá esik. A La Niña nagyon stabillá teszi a légkört, és közel ellentétes éghajlati hatásai vannak, mint az El Niño-nak, ezen túl pedig kedvező a halállománynak is.
Az elmúlt néhány évtizedben azt tapasztalták, hogy sokkal gyakrabban fordul elő az El Niño jelenség, mint korábban. Az El Niño idején a keleties passzátszelek nem a megszokott erősséggel fújnak, így Dél-Amerika nyugati partvidékén nem alakul ki a mélységből történő tápanyagban gazdag víz feláramlása, melynek következtében számottevően csökken a tengeri hal-és növényvilág. Emellett a légkör instabillá válik, nagy változásokat okozva ezzel a Föld déli féltekének időjárásában és csapadék eloszlásában.
Az El Niño jelenség hatása nem korlátozódik a tengerek élővilágára sem. A tengeri fajokkal táplálkozó állatokra gyakorolt hatását talán jól szemlélteti az alábbi tanulmány (Barbraud és Henri Weimerskirch, 2001.): Megfigyelték, hogy 1970 óta a császárpingvin (Aptenodytes forsteri) állomány 50%-kal csökkent. A pingvinek számára nagyon fontos a megfelelő mennyiségű és minőségű táplálék mellett a téli jégborítottság is. Ha sok a part menti jég, akkor soká tart a szülőknek eljutnia a vízhez. A hideg víz viszont sokkal több táplálékot jelent, így több utódot nevelhetnek fel. Az El Niño tehát két, ellentétes módon szabályozza a császárpingvinek állományát. Egyrészt növeli a szülők túlélő képességét a jégfelület csökkenése által, de a szülők és a sikeresen felnevelt utódok számát csökkenti kevés táplálék. Összességében csökken a túlélési ráta, amely végül ismét egyensúlyba áll, sokkal alacsonyabb egyedszámmal.
Área változások a Föld vizeiben
Az egyes populációk hármas válaszút előtt állnak a klímaváltozással szembesülve: alakalmazkodnak, elvándorolnak, vagy kihalnak (Woodward et Al. 2010, Wrona et al. 2006, Perkins et al. 2010). Mindhárom változatra találni számos példát. Ezek a lehetséges válaszok szárazföldi és vizi élőlényekre egyaránt érvényesek; mindkét típusú élőhelyen el lehet különíteni jelentős helyváltoztatásra képes populációkat, mint a madarak, vagy halak, melyek esetében az aktív mozgást és viselkedésbeli reakciókat is számba kell vegyük. Mindkét élőhelyen előfordulnak helytülő élőlények, mint a tengeri füvek, korallok, szárazföldi növények, melyek esetében a propagulumok passzív terjedésével kell számolnunk; egyes hosszú életű élőlények (korallok, fák) pedig meghatározzák a társulás szerkezetét, és a változó környezetben sokáig fennmaradnak, de szaporodásra nem képesek, így eltűnésük késleltetett (Mokany et al. 2010).
Az egyes populációk tér-időbeli eloszlása a környezeti változók (ezek egyike a klíma) és a metapopulációs dinamika, illetve diszperziós lehetőségek függvényében általában nem lineáris mintázatokat mutat. A klíma-fülke (climate envelope) elképzelés szerint a populációk mai előfordulási területének klíma paramétereiből, és a fajok fiziológiai tűrőképességéből megjósolhatjuk jövőbeli elterjedésüket, a különböző klíma scenariók függvényében. Ez az elképzelés még nem tartalmazza a fajok kölcsönhatásaiból és a diszperzió sebességéből adódó korlátokat. Kisebb térbeli skálán (<200 km) úgy tűnik, a populációk közti interakciók és a diszperzió, míg nagyobb léptékben (>200 km) a klíma határozza meg a fajok elterjedését (Gouhier et al. 2010). Nem minden faj képes lépést tartani a hőmérséklet változásával. A rövid életidejű és jó terjedőképességű fajok földrajzi elterjedése hamar idomul a változásokhoz; ezek a fajok új közösségeket fognak alkotni a lassabban terjedő, illetve hosszabb életű, így lassabban alkalmazkodó fajokkal (Montoya és Raffaelli 2010).
Az édesvízi élőhelyek fragmentáltsága, szigetszerűsége miatt az élőlények kevésbé képesek elterjedési területük arrébbtolódásával követni a klímaváltozás hatásait (Giller et al. 2004). A terjedés problémáját a különböző fajok eltérő mértékben képesek áthidalni. A rovarok jó terjedési képességüknek köszönhetően, könnyen elvándorolhatnak a klímaváltozás során számukra legkedvezőbb klímát kínáló élőhelyekre. A vízi meiofauna tagjai, és egyes makroszkopikus gerinctelenek szintén jó terjedőképességről tesznek tanúbizonyságot, melynek még nagyobb földrajzi gátak sem jelentenek akadályt. Egy 4 oC-os hőmérséklet emelkedés 680 km-es észak felé történő vándorlást tenne szükségessé, ha az feltételezzük, hogy az egyes fajok változatlan hőmérsékletű vizet igényelnek (Woodward et al. 2010).
Főleg a nagyobb testű állatok számára jelenthet gondot a rossz terjedőképesség. A halak között gyakran találunk egy-egy tóhoz, vízgyűjtőhöz kötött, benszülött fajokat. Amennyiben nem képesek kedvezőbb hőmérsékletű vizekbe eljutni, kénytelenek alkalmazkodni a hőmérséklet változáshoz. Ezt megkönnyíti, hogy kisebb eséllyel kell kompetítorokkal megküzdeniük, hiszen azok is akadályoztatva vannak az új élőhely elérésében. Egyes halak képesek lehetnek meghódítani északabbra eső vízgyűjtőket is. Különösen az anadrom halaknak adódnak erre jó esélyeik, ahogy ezt két lazac fajnál már megfigyelték Kanadában (Babaluk et al. 2000, Woodward et al. 2010). A jégkorszak végén a Nagy-Tavakba a Mississippi és az Atlanti régió refugiumaiból 122 halfaj vándorolt vissza. A felmelegedés várható mértékét, a táplálkozási és szaporodási igényeket figyelembe véve, 58 vizsgált halfajból további 27 vándorolhat be a Nagy-Tavakba. Sok nagy folyórendszer kelet-nyugati irányú, így kevesebb lehetőség van a populációk vízgyűjtőn belüli vándorlására (Carpenter et al. 1992, Ficke et al. 2007). Eurázsiában számos délről észak felé tartó folyó is található, az ezekben élő populációknak könnyű lehet elterjedési területük északabbra tolása (Wrona et al. 2006).
Bizonyos esetekben kimutatható, hogy a melegebbé vált élőhelyek kolonizációja csupán a diszperzió akadályozottsága miatt nem ment még végbe. Mikrokozmosz kísérletekben vizsgálták, hogy az alacsonyabb fekvésű, melegebb vizű, illetve magasabb fekvésű, hidegebb tavak planktonikus rákjai közti kompetíció kimenetele hogyan függ a hőmérséklettől. Több, melegebb vízből származó faj a hidegebb (13 oC) medencékben is versenyképesnek bizonyult, lehet, hogy ezek ténylegesen képesek lennének meghódítni a magasabban fekvő tavakat is. A magasabb hőmérsékletű (20 oC) mikrokozmoszokban a melegebb tavakból származó fajok nagyobb arányt értek el. A klímaváltozás során az alpesi tavak rezisztenciája a melegkedvelő fajok inváziójával szemben csökken (Carpenter et al. 1992, Holzapfel és Vinebrooke 2005).
Az alpesi tavakban élő fajok terjedési képessége rossz, mivel kevés vízimadár, emlős és ember működhet közre a terjedés elősegítésében. Emiatt a melegebb tavakból a potenciális új betelepülők később jelennek csak meg a számukra alkalmassá váló vizekben, ugyanakkor a hidegkedvelő fajoknak kisebb esélyük van északabbi magashegységi tavakba eljutni, ahol túlélhetik a klímaváltozást (Holzapfel és Vinebrooke 2005).
A tengeri plankton esetében figyelhetjük meg a legnagyobb mértékű area áthelyeződéseket. A nagy méretű vízi rendszereken belül sokkal hatékonyabb a diszperzió, mint akár a szárazföldön (Giller et al. 2004). Az elmúlt 50 évben a kontinentális talapzat mentén élő (pszeudo-óceáni), melegkedvelő Ceratium (Dinophyta) fajok és copepoda közösségek elterjedési határa 1100 km-rel tolódott ki északra.
Az Északi-tengerben a 20. század 70-es, 80-as éveiben a mérsékelt övi copepoda fajok kiszorították a szubarktikus fajokat. A 80-as években a szél intenzitása az Északi-tenger térségében erősödött, és a felszíni vízhőmérséklet az Atlanti-óceán északi részén, és az Északi-tengerben egyaránt emelkedett. 1984-85-ben, illetve 1987-88-ban az Északi-tenger planktonikus közösségeiben nagy arányú váltás figyelhető meg a fajösszetételben, ami egyes klíma paraméterek (szél intenzitása és iránya, felszíni vízhőmérséklet, NAO, északi félteke hőmérsékleti anomália) változásával magyarázható. Az egyes fajok kicserélődése feltehetően egymást erősítette, két egyensúlyi állapot között egy viszonyleg gyors átmenet játszódott le. Az új egyensúlyi állapotra melegkedvelő fajok jellemzőek, melyek az észak-keleti Atlanti-óceánban, főleg a kontinentális talapzat mentén fordulnak elő. Ezen fajok beáramlását az európai self menti tengeráramlatok erősödése, és ezáltal az Északi-tengerbe beáramló víztömeg is elősegítette (Beaugrand 2004).
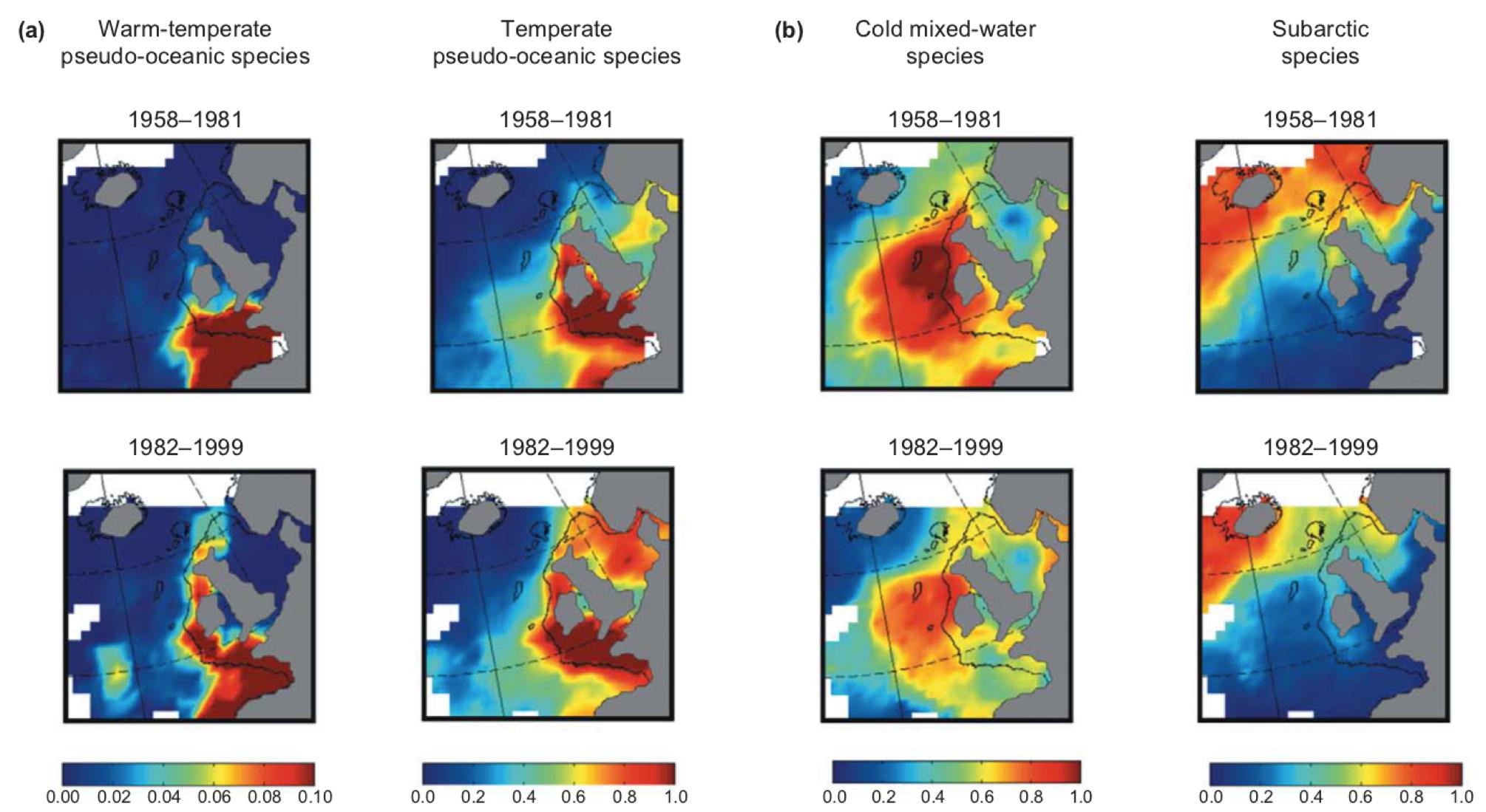
A 80-as, 90-es években az Északi-tengerben végbement változások, melyek a planktonikus közösség kicserélődéséhez vezettek (Beaugrand 2004)
Az eredeti, szubarktikus fajok nagy testűek, és nagy biomasszával voltak jelen a zooplanktonban. A mérsékelt övi fajok testmérete kisebb, és jóval alacsonyabb biomasszát alkotnak. Ráadásul, a Calanus finmarchius rendesen tavasszal volt jelen legnagyobb egyedszámban, amikor a tőkehalak lárvái ezzel a rákkal táplálkoztak. A C. finmarchiust felváltó C. helgolandicus egyedszám csúcsa őszre esik, így a tőkehal lárvák fő táplálékforrása megszűnt (Richardson 2008).
Az északnyugati Atlanti-óceánban ugyanazon copepoda közösségek elterjedése déli irányba mozdult el az utóbbi évtizedekben. A 80-as, 90-es években Labrador és Új-foundland környékén szokatlanul hideg volt a klíma, és az északról délre tartó Labrador-áramlás erősödött (Richardson 2008).
Hasonló nagyságrendű változás az antarktiszi óceánban a krill visszaszorulása: az (Euphasia superba) egyedsűrűsége a 70-es évektől csökken; a krill mennyisége pozitív összefüggést mutat a klorofill koncentrációval, és a téli jégborítással. A krill fontos táplálékai ugyanis a jég alatt élő algák. A szalpák (Urochordata) a krillel szemben a melegebb vizet és az alacsonyabb produktivitású területeket kedvelik. A szalpák elterjedési területe a krill visszaszorulásával párhuzamosan, délebbre tolódott. Minthogy a krill a táplálékhálózat magasabb szintjeinek alapját jelenti, ez az átrendeződés kihatással lehet a bálnák, pingvinek, tengeri madarak és halak populációira is (Atkinson et al. 2004). A krill nem képes hatékonyan táplálkozni a kisebb méretű algasejteken, míg a szalpák igen. A jégborítás csökkenése és a zooplankton változásai miatt az Adélie-pingvinek populációja 90 %-kal zsugorodott a 70-es évektől napjainkig (Sarmento et al. 2010).
Ha az areák eltolódását vizsgáljuk, külön említést kell tennünk a kis méretű élőlényekről, melyek között nagy arányban találunk kozmopolita fajokat. Az 1 mm-nél kisebb testméretű fajok gyakran minden élőhelyen megtalálhatóak, az egész Földön (Finlay 2002, Perkins et al. 2010). Például, egyetlen tó 0,1 cm3-es üledék mintájából a Paraphysomonas protiszta genusz egész világon ismert fajainak 80 %-át sikerült kimutatni. Úgy tűnik, az egysejtű csoportok fajai mindenhol jelen vannak, és az aktuális körülményeken múlik, hogy az általános fajkészletből melyek szaporodak el. Ez arra enged következtetni, hogy a klímaváltozáshoz való alkalmazkodás a legkevésbé jelent gondot ezeknek a kis méretű élőlényeknek, mivel azonnal tudnak reagálni az adott hőmérsékleten leginkább versenyképes faj elszaporodásával (Finlay 2002). Az algák jó terjedőképességét figyelembe véve, nem valószínű, hogy az elkövetkezendő száz évben várható, 3 fokot meghaladó felmelegedés súlyosan károsítaná ezeket a közösségeket (Moss et al. 2003).
Evolúciós változások
Bár a klímaváltozás az evolúció léptékével mérve gyorsan történik, de egyes fajok képesek ilyen rövid idő alatt is evolúciós választ adni. Ezek a válaszok döntőek lehetnek a populációk fennmaradása szempontjából.
Mikroevolúciós változások módosíthatják az egyes populációk hőmérsékleti változásokra adott reakciógörbéit. Kísérleti mezokozmosz közösségekben nevelt Daphnia magna és D. pulex populációk esetében a belső növekedési ráta nőtt, az ivarérett korra elért testméret pedig csökkent a magasabb hőmérséklet hatására. Ezek a hatások a fenotípusos plaszticitás kategóriájába sorolhatók, azonban hat hónap hőkezelés során az ivarérett kori testméret, mikroevolúciós változásoknak köszönhetően, növekedni kezdett (Doorslaer et al. 2009, Doorslaer et al. 2010). Alacsonyabb és magasabb szélességi fokokról származó, természetes D. magna és D. pulex populációkkal kompetíciós kísérletekben hasonlították össze a hőmérsékleti kezelést kapott, illetve a kontroll Daphnia klónokat. Így sikerült igazolni, hogy a végbement gyors evolúciós válaszok adaptívak voltak, növelték az adott klón fitness-ét a melegebb környezetben. A melegebb égtájról származó bevándorló klón több mint kétszer annyi idő alatt szorította ki a másfél éven át magasabb hőmérsékletnek kitett helyi klónt, mint az eredeti hőmérsékleten neveltet. \par
Az adatokra illesztett szimulációs modell szerint, valós populációkban 104-106-szor nagyobb bevándorlási ráta szükséges a helyi változat kiszorításához ilyen fokú előzetes alkalmazkodás esetén (Doorslaer et al. 2009, Doorslaer et al. 2010).
Bár a kísérlet ideje alatt nem alakulhatott ki különbség a Daphniát fogyasztó predátorok (Zygoptera, Chaoborus) abundanciájában, a magasabb hőmérséklet megnövelte a predátorok aktivitását. A predátorok a kisebb méretű egyedeket preferálják, így a D. magna és D. pulex populációk aránya megváltozott, a nagyobb méretű D. magna javára. Ugyanakkor ez a hatás része lehetett annak a szelekciós nyomásnak, ami a fenotipikus plaszticitásnak megfelelően lecsökkent testméret megnövelése irányába genetikai változásokat eredményezett (Doorslaer et al. 2009, Doorslaer et al. 2010).
A hőmérséklet emelkedés hatására végbemenő gyors evolúciós változások módosíthatják a klímaváltozás fajok elterjedésére, közösségek összetételére gyakorolt hatását, ezért érdemes ezeket figyelembe venni az előrejelzések, modellek készítésénél. Azonban nem várható, hogy a populációk ily módon kivédjék a klímaváltozás kedvezőtlen hatásait, ugyanis a melegebb környezethez való alkalmazkodást előrevivő genetikai változásokat a csereviszonyok korlátozzák. Egyes Daphnia populációk a mezokozmosz kísérletek során a melegített medencékben kihaltak, pusztán a közösségben megváltozott kompetíciós és predációs viszonyok miatt. Ha pedig egy másik, melegebb környezethez jobban adaptálódott változat, vagy melegkedvelő faj hamarabb megjelenik az élőhelyen, a helyi populációnak nincs ideje alkalmazkodni, és kihalhat (Doorslaer et al. 2010).
A táplálékhálózatok változásai a Föld vizeiben
A fajok elterjedésében és fenológiájában bekövetkező változások eredményeként egyes fajok eltűnnek a táplálékhálózatokból, a táplálkozási kapcsolatok erősödnek vagy gyengülnek. Az azonos funkciós csoportba tartozó populációk kompetíciója is hőmérsékletfüggő. Egy elkerítéses kísérlet során, 25 oC felett a kisebb testű Cerodaphnia reticulata nyert, és a Daphnia pulex kihalt; alacsonyabb hőmérsékleteken pedig fordítva (Lynch 1978).
A különböző földrajzi szélességekről származó vízi táplálékhálózatok összehasonlítása azt mutatja, hogy az egyes trofikus szintek és funkciós csoportok aránya klímafüggő. A vízfolyások makrogerinctelen közösségei például délről észak felé haladva egyre kevesebb fajból állnak, és egyre nagyobb a dipterák jelentősége (Wrona et al. 2006).
Szubtrópusi és mérsékelt övi tavak közösség szerkezetét összehasonlítva, szembetűnő, hogy a melegebb égövi tavakban a halak diverzitása és abundanciája jóval magasabb a mérsékelt övi tavakéhoz képest. A növényzeten élő makrogerinctelenek épp ellenkező képet mutatnak: a hidegebb tavakban nagyobb a diverzitásuk és egyedsűrűségük. A különbségek akár tízszeres denzitást jelenthetnek, mind a halak, mind a gerinctelenek esetében (Meerhoff 2006, Jeppesen et al. 2009). Erős top-down kaszkádon keresztül, a halak hatással vannak a fitoplanktonra és a perifitonra is (Meerhoff 2006).
A melegebb tavakban és folyókban a halak ivarérése gyorsabb, testméretük kisebb, több energiát allokálnak a szaporodásba (Palmer et al. 2009, Mooij et al. 2010). A hal biomassza a mérsékelt és hideg égövi tavakban pozitív összefüggést mutat a foszfor koncentrációval, a trópusi tavakban viszont egyenletesen magas a halak biomasszája, függetlenül a foszfortól. Ennek oka lehet, hogy a halak egész évben szaporodhatnak, és sokkal inkább omnivórok, mint a hidegebb tavakban élő társaik. Az omnivória magas hal biomasszát eredményez, ami folyamatosan erős predációs nyomás alatt tartja a zooplanktont (Gyllstrom et al. 2005).
250 dániai tó nyári állapotát vizsgálva, a melegebb tavakban a halak között a zooplankton fogyasztók válnak gyakoribbá, a herbivórokkal szemben (Jeppesen2009, Mooij2010). Az így megnövekedett predáció hatására a zooplankton átlagos testmérete csökken, és a Daphniák aránya megnő; a zooplankton/fitoplankton arány pedig csökken (Jeppesen et al. 2009). A Müggelsee május-júniusi magasabb vízhőmérséklete pozitívan befolyásolja az azévi halivadékok növekedését, melyek csökkentik a Daphniák populációját (Mooij et al. 2005). A magasabb téli hőmérséklet a hideg jelentette ozmoregulációs stressz, és a fagyás veszélyének csökkenése révén segíti a halak áttelelését (Carpenter et al. 1992, Mooij et al. 2010).
A sekély tavakban a halaknak fontos szerepe van a zooplankton biomasszájának szabályozásában. A hőmérséklet 81 európai sekély tó adatai alapján, pozitív hatással van a halak biomasszájára, és feltehetően ezen keresztül, negatív hatás érvényesül a zooplanktonra. A top-down trofikus kaszkád a fitoplanktonra pozitívan hat. A zooplankton/klorofill arány a hidegebb tavaktól a melegebbek felé haladva csökken. Ehhez bottom-up mechanizmusok is hozzájárulhatnak, mint a kevésbé fogyasztható Cyanobacteriumok arányának növekedése a hőmérséklettel. A legmelegebb vizsgált tavakban a zooplankton még halak hiánya esetén sem volt képes a fitoplankton kontrollálására, tehát ezeknél a meleg tavaknál a bottom-up hatások nagyobb jelentőséggel bírnak. Nem világos, hogy miért jellemző ezekre a tavakra magas hal/zooplankton arány is (Gyllstrom et al. 2005). Különböző földrajzi szélességeken felállított, sekély tavakhoz hasonló mezokozmoszok közül a délebbiekben a tápanyag hozzáadása erőteljesebb hatást gyakorolt a zooplanktonra, tehát a bottom-up hatások jelentősebbek voltak a melegebb hőmérsékleten (Moss et al. 2004).
A szubarktikus tavakban az oxigénhiányos zónák kiterjedése a tavipisztráng (Salvelinus namaycush) eltűnését eredményezheti rövid időtávon belül (McDonald et al.1996, Hobbie et al. 1999). Eddigi tapasztalatok alapján, a tavipisztráng eltávolítása a kisebb halak elszaporodását, és a nagyobb gerinctelen állatok eltűnését vonja maga után. Egy kísérlet során a tavipisztráng eltávolítása a menyhal (Lota lota) elszaporodását idézte elő, mely a Chiromonidae lárvákat nagy mennyiségben fogyasztó botos kölöntét (Cottus gobio) visszaszorította. Ebből látszik, hogy a csúcsragadozók felmelegedés okán bekövetkező eltűnése a trofikus kaszkádok által szerteágazó változásokat gerjeszt a táplálékhálózatban (Hobbie et al. 1999).
A tavipisztráng növekedésére nagy hatással van, hogy tavasszal meddig táplálkozhat a part menti zónában, milyen hamar szorítja ki onnan a melegedő víz. Ez a periódus 9 fokos levegő hőmérséklet emelkedés esetén, a jelenlegi 28 napról mindössze 4 napra csökken. Ősszel viszont növekszik az optimális táplálkozásra lehetőséget adó időszak, azonban ez már a tavipisztráng párosodási időszakába esik, ami akár 6 héttel is későbbre tolódhat. A sárga sügér ( Perca flavescens) számára alakalmas élettér 4 oC-os melegedés esetén bővülni fog, mind térben, mind időben. 9 oC-os emelkedéssel számolva azonban szinte teljesen eltűnnek az e faj számára megfelelő hőmérsékletű vízterek (Jansen és Hesslein 2004).
A halak esetében a magasabb hőmérséklet gyorsabb növekedést eredményezhet, ha van elegendő táplálék. Ennek hiányában a halak hidegebb vizeket keresnek fel, vagy ha ez nem lehetséges, éhezés lép fel (Jansen és Hesslein 2004).
Geotermikus hatások alatt álló izlandi vízfolyások öszehasonlítása során hasonló jelenséget sikerült megfigyelni. A pisztrángok gyakorisága pozitív összefüggést mutat a hőmérséklettel. A hidegebb vízfolyásokban gerinctelenek, a melegebbekben pisztrángok a csúcsragadozók. A pisztrángok válogatás nélkül, előfordulásuknak megfelelő gyakoriságban fogyasztották a gerincteleneket, de magasabb hőmérsékletű vízfolyásokban a pisztrángok magasabb trofikus szintre tolódtak, a táplálékláncok átlagos hossza a hőmérséklettel nőtt. Ez utóbbi jelenséget a pisztrángok és az elsődleges fogyasztó gerinctelenek N15 tartalmának arányaival is sikerült alátámasztani. A pisztrángok testmérete is nő a trofikus szinttel párhuzamosan, valószínűleg a zsákmányállatok nagyobb méretéhez alkalmazkodva (Woodward et al. 2010c}.
A mérsékelt övi és szubarktikus halpopulációk erősebb parazita fertőzöttségnek lehetnek kitéve a felmelegedés nyomán, az átadási lehetőségek növekedése miatt. Az említett területeken a téli hideg a fő limitáló tényező a paraziták terjedése szempontjából. A tél melegedése a téli nyugalmi periódus rövidülésével vagy megszűnésével, egész éven át tartó fertőzési lehetőséggel, illetve egy éven belül több parazita generációval, ezáltal nagyobb szaporulattal járhat. A mérsékelt övi vizekben sok parazita főleg kora tavasszal fertőz, amikor a halak még gyengébb kondícióban vannak az áttelelést követően. Az enyhébb telek ilyen esetben csökkenthetik a fertőzések arányát. Noha a populációk elterjedési területe a klímaváltozás következtében változni fog, az áthelyeződés egyes fajok szintjént játszódik le, nem pedig egész közösségek szintjén. Elképzelhető, hogy egyes paraziták a megváltozott környezetben képtelenek lesznek életben maradni (Ficke et al. 2007).
A hideg égövben a felmelegedés jellemzően a magasabb trofikus szintek megerősödését, a produkció növekedését, a táplálékláncok átlagos hosszának növekedésévet váltja ki.\par
A Baffin-sziget hat tavának üledékmintáiból kiderül, hogy a 20. század folyamán a primer produkció nagy arányú növekedése ment végbe a tavakban (Michelutti et al. 2005). A skóciai Loch Leven tó esetében a fitoplankton téli, és a zooplankton tavaszi produkciójának növekedése volt megfigyelhető (Carvalho és Kirika 2003). Hollandiai tavak átfogó elemzése alapján a növekvő primer produkció a magasabb trofikus szintekre is kihat. A növekvő produkció összességében eutrofizációhoz vezethet (Mooij et al. 2005).
Az alaszkai Wood River tórendszerében a jég korábbi feltörése, és a hőmérséklet emelkedése nyomán a zooplankton, elsősorban a Daphnia egyedsűrűsége megnőtt, emiatt a vörös lazac (Oncorhynchus nerka) egyedei nagyobb tömegnövekedést értek el első életévük folyamán, ezt a pozitív hatást azonban csökkentette az idősebb példányok megnövekedett egyedsűrűsége (Schindler et al. 2005). A svédországi Erken-tóban, egy hidrológiai modell alapján jósolt javuló fényviszonyok miatt, többszörösére nőhet a fitoplankton biomasszája. Fény limitáció helyett tápanyag limitáció léphet életbe. A nagyobb biomassza, és a kovaalgák nagyobb aránya az elhalt algasejtek ülepedése által, a bentikus közösség biomassza növekedéséhez vezet (Blenckner et al. 2002).
A leghidegebb élőhelyeken bizonyos hőmérséklet felett jelenik csak meg a harmadik trofikus szint. Ez a folyamat a top down-kontroll erősödésével, a produkció növekedésével jár (Flanagan et al. 2003, Gyllstrom et al. 2005). Ezzel párhuzamosan érvényesül egy másik hatás, hogy zavarás esetén a magasabb trofikus szintekről nagyobb eséllyel vesznek el fajok (Petchey et al. 1999, Petchey et al. 2004).
Mikrokozmosz kísérletetekkel vizsgálták a hőmérséklet hatását kettő, illetve három trofikus szintű táplálékláncokra. Amikor csak fitoplankton és Daphnia volt jelen, a rendszer instabilnak bizonyult, a Daphnia előbb-utóbb kihalt. Egy ragadozó laposféreg hozzáadása 25 oC-on tovább destabilizálta a táplálékláncot, gyorsította a kihalást. 18 oC-on ilyen hatás nem volt kimutatható. Még egy fitoplankton fogyasztó faj hozzáadása sem változtatott ezen a tendencián (Beisner et al. 1996, Beisner et al. 1997).
Egy másik mikrokozmosz kísérlet a melegítés trofikus szintek és funkciós csoportok arányára gyakorolt hatását vizsgálta. Petchey több trofikus szintű táplálékhálózatot vizsgáló mikrokozmosz kísérlete nem különböző hőmérsékleteket alkalmazott kezelésként, hanem hőmérsékletnövekedést: 7 hétig, hetente 2 oC-kal növelte a hőmérsékletet. Négy féle, egysejtűekből és kerekesférgekből álló táplálékhálózatot állított össze, melyek közül kettő alacsony, kettő pedig magas diverzitású volt. Ez utóbbiaknál a táplálékhálózatban minden funkciós csoportba több faj tartozott, míg előbbiek esetében csak egy-egy faj. A melegített mikrokozmoszokból a fajok 30-40 %-a kihalt, míg az állandó hőmérsékletűekből csak 18 %. A melegítés növelte a bakterivór biomasszát, az elsődleges produkciót, és a lebontó folyamatokat. A magasabb trofikus szintekről nagyobb arányban halnak ki fajok a felmelegedés hatására, ennek tudható be az autotrófok és a bakterivórok megnövekedett aránya (Petchey et al. 1999). Egy hasonló mikrokozmosz kísérletben, 10 és 20 oC-os hőmérsékleti kezelés során, a bakteriális biomasszában nem tapasztaltak különbséget. A csillósok bimasszája magasabb volt, valószínűleg a predáció megakadályozta a baktériumok mennyiségének növekedését, a 2-5 mikron nagyságú sejtek aránya emiatt csökkent (Rae és Vincent 1998).
A klímaváltozás várható hatásai az édesvizekre
Az édesvizek a biológiai sokféleség aránytalanul nagy hányadát tartalmazzák: csupán a Föld területének 0,8 %-át borítják, ugyanakkor a fajok 6 %-ának szolgálnak élőhelyül. Az emberiség számára nyújtott ökoszisztéma szolgáltatásaik szempontjából is különösen jelentősek. Ennek fényében aggasztó, hogy éppen ezeket az élőhelyeket erősen veszélyezteti a klímaváltozás.
Az édesvizek esetén a drasztikus felmelegedés és az aszályos időszakok gyakoribbá válása élőhelyek teljes eltűnését is okozhatja. Ilyen veszélyeztetett élőhelyek a visszavonuló gleccserek, a kiszáradó folyóvizek és tavak.
A klímaváltozással gyakoribbak lesznek az aszályok, melyek a tavak, vízfolyások kiszáradását okozhatják (Meyer et al. 1999). Egy vízfolyások havonta illetve három havonta történő kiszáradását viszgáló kísérlet eredményei szerint, a kiszáradás hatására a felületeken élő alga közösségben domináns zöld algát kovamoszatok váltották fel, és a nagyobb, ritkább gerinctelenek eltűntek (Woodward et al. 2010). A mocsarak, lápok esetében a hosszabb meleg, száraz periódusok, illetve a talajvíz folytonosságának megszűnése a feltöltődést, beerdősülést gyorsíthatják (Burkett et al. 2005). Globális méretekben csökkenhet a sekélyvízi habitatok (kisvízfolyások, öblök, lápok, mocsarak, sekély tavak, parti zónák) mennyisége (Carpenter et al. 1992).
A kontinensek belsejében feltehetően kevesebb csapadék, és kisebb vízhozam várható. A szárazabb vízgyűjtők érzékenyebbek a csapadék mennyiség változására. Az Észak-Amerikai Nagy Medencében például, a mocsarak és tavak zsugorodására lehet számítani. A csapadék évszakok közti eloszlásában jelentősebb változások lehetnek, mint az éves csapadékösszegben (Carpenter et al. 1992).
Számolnunk kell azzal is, hogy az eddig kidolgozott biológiai vízminősítési rendszerek használhatatlanná válhatnak a hőmérséklet emelkedésével, hiszen egy korábbi, hidegebb időszakban felmért ökológiai állapotot tekintenek referenciának. (Woodward et al. 2010).
A tavak érzékenyen reagálnak a klímaváltozásra, változásaik az egész vízgyűjtő területükre eső hatásokat reprezentálják, állapotuk hosszab időszak történéseit tükrözi, így kiszűrődik a véletlenszerű zaj; azonban nehéz elkülöníteni a klimatikus hatásokat más antropogén stresszorok hatásaitól, mint az eutrofizáció, a savasodás, és a földhsználat változásaival járó egyéb hatások (Adrian et al. 2009, Woodward et al. 2010). A mély tavak hipolimnionja nagy tehetetlenséggel követ minden klimatikus változást, mindemellett a Tanganyika tó 600 m mélységben mért hőmérséklete a 20. század folyamán 0,31 o C-kal emelkedett (OReilly et al. 2003).
Az éghajlatváltozásnak alapvetően két fontos hatása van az édesvízi ökoszisztémákra:
- a hőmérséklet emelkedése eredményeként a vízhőmérséklet is növekedni fog
- a csapadék szezonális mintázatában bekövetkező változás a vízi rendszerek hidrológiai viszonyait is megváltoztatja.
Mindkét eset hatással van az adott közösség fajkompozíciójára és a vízi ökoszisztémák produktivitására (Poff et al. 2002). Elmondható továbbá, hogy a vízi ökoszisztémák különösen érzékenyen reagálnak a klímaváltozásra és ezt csak tovább fokozzák az emberi tevékenységből származó terhelések. Éppen ezért a jövőre nézve nagyon fontos, hogy lehetőleg minél többet tudjunk a rendszer szerkezetéről és működéséről.
A vizek hőmérsékletének emelkedése egyrészt közvetlen élettani hatással bír a benne élő szervezetekre a hőmérsékleti toleranciájukon keresztül. Ez a többnyire fajspecifikus hatás nagyobb veszélyt jelent egy ún. sztenoterm, igen szűk termális toleranciájú fajra (pl a Salvenius alpinus szajblingfaj), mint egy ún euriterm, széles termális toleranciatartománnyal bíró faj (pl. a ponty, Cyprinus carpio) esetében (Ficke et al. 2007). A halak példájánál maradva, azok fiziológiai folyamatai, mint: növekedése, reprodukciója és aktivitása, közvetlenül befolyásolt a hőmérséklet által (Schmidt-Nielsen 1990). A megváltozott környezetre a fajok migrációval vagy akklimatizációval válaszolhatnak. Az endémikus fajok és a fragmentált élőhelyek fajai, vagy a kelet-nyugati orientációjú rendszerek kevésbé képesek követni a hőmérséklet drasztikus emelkedésének köszönhető élőhelyváltozást (Ficke et al. 2007). Amellett a megváltozó hidrológiai állapotokat jobban tolerálni képes invazív fajok terjedése is valószínűsíthető (Baltz & Moyle 1993). Daufresne et al (2009) szerint a vízi szervezetek esetén a globális felmelegedés harmadik általános hatása a fajok areájának a sarkok irányába való eltolódása és az életciklusban megfigyelhető szezonális elmozdulás mellett a testméret csökkenése lehet, amely összhangban áll a testméret és hőmérséklet közti ökológiai összefüggésekkel (pl. Bergmann szabály).
Másrészt a felmelegedés számos további változást indukál a vizek fizikai és kémiai jellemzőiben. Ilyen közvetett hatások az oldott oxigén szintjének csökkenése, a toxicitás változásai (többnyire fokozódása), valamint változások a trofitásban (amelyek a legtöbb jel szerint az eutrofizáció irányába mutatnak) és a termális rétegzettségben.
A biológiailag hozzáférhető (oldott) oxigén (DO, mint „dissolved oxigen”) mennyisége kapcsolatban áll a víz hőmérsékletével. Az oxigén egyrészt diffúzió útján (pl. szél általi felkeveredés) másrészt biológiai úton, a fotoszintézis révén juthat a vízbe. A növényi, állati és mikrobiális légzés csökkenti a DO-t, különösen éjszaka, amikor a fotoszintézis okozta oxigén felszabadulás szünetel. Ha az oxigén koncentrációja 2-3 mg/l alá süllyed, az már hypoxia-t jelent. Az oxigén vízben oldhatósága inverz kapcsolatban áll a víz hőmérsékletével. A hőmérséklet emelkedésével a DO csökken, azzal párhuzamosan viszont a biológiai oxigénigény (BOD, mint „biological oxigen demand”) növekszik (Kalff 2000). Így ez a folyamat a legtöbb rendszerben kettős negatív hatást jelent a vízi szervezetekre. Az eutróf folyóvizek mellékágaiban a nagytömegű fitoplankton a termelés-lebontás “természetes” folyamatára is kedvezőtlen hatású. Erre figyelmeztet a szigetközi és gemenci mellékágak esete is, ahol, ha nagy tömegű volt a fitoplankton, a felszínen oxigén túltelítettség, a mélyebb rétegekben akár teljes oxigénhiány is kialakult (Kiss et al 2007b).
Számos kísérlet vizsgálta a hőmérséklet hatását a toxicitásra. Általában a hőmérsékletfüggő toxicitás az idővel csökken (Nussey et al. 1996). Másrészt a szennyezőanyagok toxikussága a hőmérséklet emelkedésével fokozódik (Murty 1986.b). Továbbá a hőmérséklet emelkedése és a toxikus szennyezőanyagok felvétele között pozitív korreláció ismert (Murty 1986.a). Poikilotherm élőlények (pl. halak) metabolizmusa a hőmérséklet emelkedés hatására gyorsul, amely közvetetten a toxikus anyagoktól való tisztulás folyamatát gyorsítja (MacLeod & Pessah 1993). Amellett viszont a mérgező anyagok vízi élőlényekben történő akkumulációja is gyorsul a magas hőmérséklettel (Köck et al. 1996). Mindezek alapján a hőmérséklet emelkedése a szennyezőanyagok toxicitásának fokozódását okozza.
Ábbár a belföldi vizek eutrofizációja alapvetően a tápanyagterhelésre vezethető vissza, a globális felmelegedés a vízhőmérséklet emelkedésén és a rétegzettségi mintázatok megváltozásán keresztül közvetett hatást gyakorolhat a belföldi vizek trofikus állapotára és a primer produkcióra, különösen lenitikus élőhelyeken (Lofgren 2002). A bakteriális metabolizmus, a tápanyag körforgásának rátája és az algák mennyiségi növekedése a hőmérséklet emelkedésével fokozódik (Klapper 1991). Ámbár a felmelegedés és az eutrofizáció közötti összefüggések feltárása meglehetősen összetett és bonyolult kérdéskör, a legtöbb tanulmány alapján általánosságban elmondható, hogy a klímaváltozás inkább az eutrofizáció erősödését eredményezi (Allan et al. 2005), ez a hatás pedig az antropogén szennyezéshez kapcsoltan különösen érzékenyen érintheti az édesvizek trofikus állapotát (Klapper 1991; Adrian et al. 1995). Másfelől viszont a klímaváltozásnak egy ellenkező irányú hatása is elképzelhető, amennyiben a rétegzettség kifejezettségének és időtartamának növekedése a tápanyagok hipolimnionba történő visszaszorulását eredményezheti, ahol azok elérhetetlenné válnak a primer producensek számára (Magnuson 2002). Természetesen mindez valódi, mély tavak esetén lehet igaz, ahol világosan elkülöníthető az afotikus, trofolitikus réteg. Mivel az édesvízek minősítése szempontjából a trofitás kiemelt jelentőséggel bír, külön alfejezetet szentelünk a klímaváltozás trofitást érintő hatásainak részletesebb ismertetéséről.
A globális légkörzési modellek előrejelzései szerint a klímaváltozás azonban nem pusztán hőmérséklet emelkedését jelenti. A csapadék szezonális mintázata és azzal összefüggésben az áradások is változni fognak. A szélsőséges időjárási események gyakorisága a vízi rendszerekben is fokozódhat (Magnuson 2002). A vízi organizmusok populációi közvetve érzékenyek lehetnek az extrém csapadékhullási események gyakoriságára, időtartamára és időzítésére is, ide értve az extrém száraz vagy bővizű időszakok eseményeit. A szárazság és a száraz időszakok hosszabbodása hatással lehet a fajkompozícióra, amellett számos populáció hanyatlását is okozhatja (Matthews & Marsh-Matthews 2003). Ezek mellett a hóolvadás szezonális elcsúszása változást gyakorol a folyók fizikai viselkedésére, amely számos vízi élőlény reprodukciós időszakának elmozdulását okozhatja (Poff et al. 2002). A jégtáblák olvadásának köszönhető tengervízszint-emelkedés szintén negatív hatással lehet a folyótorkolatok közösségeire, az erózió fokozódását eredményezve a torkolatvidékeken (Wood et al. 2002). Amellett a tengervíz folyókba történő beáramlása fokozódhat a tengervízszint emelkedése miatt, ráadásul a folyamatot a szárazság tovább erősíti, mert annak következtében a folyók áramlása lassul.
A klímaváltozás az ultraibolya sugárzás fokozódását okozhatja. Az UV-B sugárzás befolyásolhatja a primer producensek túlélését, és az oldott szerves szén biológiai elérhetőségét. Az acidifikáció vagy szennyeződés, UV-B sugárzás és eutrofizáció közötti összefüggések azonban kevésbé ismertek, annak ellenére, hogy jelentős hatással lehetnek a tavi rendszerekre (Magnuson 2002; Allan et al. 2005).
Hidrológiai változások az édesvizekben
Tavak
A nagyobb tavak esetében – az óceánokhoz hasonlóan – a hőmérséklet növekedése a rétegzett állapotnak kedvez, amikor a felsőbb vízrétegek melegebbek, mint a mélyebben lévők, így a keveredés gátolt. A keveredés mértékét a szél intenzitásának változása is befolyásolja.
A mérsékelt övi Washington-tavon a meleg beköszöntével, április környékén rétegzettség alakul ki, ami késő őszig fennáll, a rétegzettség kialakulásával egyidőben tapasztalható a tavaszi kovaalga csúcs. Ezek a folyamatok a 1962-2002 között 20 nappal korábbra tolódtak, miközben a március-júniusi időszak átlaghőmérséklete 1,39 oC-kal emelkedett (Winder és Schindler 2004).
A Zürichi-tó epilimnion hőmérséklete 1947-től 1998-ig évtizedenként átlagosan 0,24 oC-al emelkedett, míg a hipolimnion hőmérséklete 0,13 oC-al. A vízoszlop stabilitása (Schmidt-stabilitás) 20 %-kal növekedett, a rétegzett időszak hossza évi 2-3 héttel meghosszabbodott ezen idő alatt (Livingstone 2003).
A világ sok részén a felmelegedéssel az éjszakai minimum hőmérsékletek növekedtek, miközben a napközbeni maximum hőmérsékletek állandóak maradtak. Az epilimnion hőmérsékletének alakulása megfelel a napi minimum hőmérséklet változásainak. A melegedés közvetlen mechanizmusa az atmoszféra éjjeli infravörös kisugárzásának csökkenése, illetve a víz-levegő felületen a víz éjszakai hőleadásának csökkenése. A hipolimnion hőmérséklet emelkedése elsősorban a téli középhőmérséklet növekedésével függ össze. A felmelegedéssel a dimiktikus tavak monomiktikussá válhatnak, még melegebb években pedig a rétegződés egész évben folyamatos lehet. Ez utóbbi esetben a hipolimnion oxigén koncentrációja rendkívül alacsonyra süllyed (Livingstone 2003).
Jansen és Hesslein a levegő hőmérsékletét, a szelet, a párolgást és a besugárzást figyelembe vevő modellel szimulálták a víz hőmérsékletének alakulását különböző klimatikus környezetben. Az egyes halfajok számára megfelelő hőmérsékletű víz rendelkezésre áll, azonban tér- és időbeli eloszlása megváltozik. Például a tavipisztráng által igényelt 5-15 oC fokos vízhőmérséklet tavasszal egyre rövidebb ideig található meg a felszínen, ősszel pedig egyre később következik be az a periódus, amikor a tó teljes térfogata ebbe a hőmérsékleti tartományba esik (Jansen és Hessein 2004).
A jégborítás időtartamának változása szintén jelentős hatással van a mérsékelt- és hideg égövi tavak ökoszisztémájára. Az alaszkai Wood River tórendszerében a tavaszi jég zajlás 7 nappal előrébb tolódott a 20. század utolsó három évtizedében, miközben a nyári vízhőmérséklet emelkedett (Schindler et al. 2005). Az ontario-i 239-es tóban 1970 és 1990 között 2 oC fokkal emelkedett a víz hőmérséklete, így 20 nappal csökkent az éves jégborítás időtartama (Jansen et al. 2004). A svédországi Erken-tó hidrológiai modelljét a jelenlegi, illetve kétszeres CO2 koncentrációval számoló klíma szcenáriók adatsoraival futtatva, az eredmények szerint a jégborítás időszaka rövidül, egyes években meg is szűnik, és a felkeveredés időszaka hosszabb lesz, de a rétegződés erősödik, és időtartama is megnő. A változások ökológiai hatására, eddigi adatsorok alapján becslés született. A jégborítás időszakában ma jellemző dinoflagellata dominanciát felválthatja a jégmentes tavakra jellmző kovamoszatok uralta fitoplankton (Blenckner et al. 2002).
55 darab, sarkvidéki tavakból származó üledékminta vizsgálata megmutatta, hogy az elmúlt 150 évben a kovaalga közösség ezekben a tavakban radikális átalakulásokon ment keresztül. A melegedéssel megváltozott a bentikus és planktonikus kovaalga fajok aránya, mivel a hosszabb jégmentes időszak utóbbiaknak kedvezett. Ennek következtében változások következtek be a Chironomidae fajok arányaiban is, mivel ezek a Diptera lárvák a bentikus kovaalgákkal táplálkoznak. A változások mértéke arányos volt az elmúlt évtizedek hőmérséklet emelkedésével. Ahol hosszabb időszakról állnak rendelkezésre paleoökológiai adatsorok, a legutóbbi évtizedek változásai jóval nagyobbnak bizonyultak, mint az elmúlt évszázadokban bármikor (Smol et al. 2005). A kovaalga közösség hasonló megváltozását írták le alpesi tavaknál (Battarbee 2000, Battarbee et al. 2002, Clarke et al. 2004, Koinig et al. 2002).
A nagyobb tavak tartósan alacsony vízszintjének káros biológiai hatásai a fokozott párolgás és a hozzáfolyás mérséklődése miatti betöményedésből adódhatnak, ami okozhatja a szikes jelleg növekedését is. A nyári aszály a halak természetes ívóhelyeinek és az ivadékok védett élettereinek korai kiszáradását, ezáltal a szaporulat pusztulását okozhatja. Szárazra kerülhet számos értékes élőhely, mint a parti kövezések, mocsári növényzettel benőtt sekély zónák.
Azonban nem minden élőlényre hat negatívan az alacsony vízszint. Táplálkozási módjuk miatt az úszórécéknek kedvező az alacsony vízállás, ilyenkor lényegesen gyakoribbak, mint magas vízállás esetén. A Balatonon a leggyakoribb a tőkés réce, de előfordul a többi faj, a kanalas réce, kendermagos réce, fütyülő réce, nyílfarkú réce, böjti réce, csörgő réce is. Főleg a téli időszakban tömegesek, ha nem fagy be a víz.

A gyakori tőkés réce (Anas platyrhyncos) (fotó: Csörgő Tibor)

Nagyobb állóvizeink tömeges őszi és tavaszi átvonulója, ill. téli vendége, a csörgő réce (Anas crecca) (Fotó: Csörgő Tibor)
A makrovegetációban is elképzelhetők változások: a Balatonon a nyári alacsony vízszint a jellegzetes hínárosok helyett ( Potamogeton perfoliatus, Myriophyllum spicatum) más, melegkedvelő hínárfajoknak kedvez. Ilyen például a nagy tüskéshínár (Najas marina), ami ráadásul a szikes jelleget is kedveli.

Melegebb, szikes vizet kedvelő nagy tüskéshínár (Najas marina) (forrás: http://sites-nature.aquitaine.fr)
Az összes hínár szempontjából a vízszint csökkenése egyrészt előnyt jelent, mert a sekélyebb vízoszlop könnyebb átvilágíthatósága következtében elvileg nagyobb területet képesek elfoglalni, másrészt a sekélyben a szél általi üledék felkeveredése is jelentősebb, ami viszont az áttetszőség drasztikus csökkentésén keresztül jelentősen megnehezíti a hínár fejlődését, különösen vegetációs idejének kezdetén. A hínárosok felületül szolgálnak a halak táplálékát jelentő számos apró szervezet számára, valamint búvóhelyet is nyújtanak a tó halászati és horgászati szempontból is értékes halfajai számára. Az erősebb hínárosodottság azért is kedvező lehet, mert a hínár az algatömeg produkció antagonistája, ugyanis a tavasszal fejlődésnek induló hínáros nagy mennyiségű tápanyagot von el az iszapból és a tó vizéből, ezért a fejlődési maximumát később elérő algapopuláció már nem tud erőteljesen kifejlődni. A nagy tömegű alga produkció viszont árnyékolásával gátolja a hínár fejlődését. Az 1995-től észlelhető csökkent algásodás, és a 2000-től kezdődő vízszintcsökkenés elvileg a hínár újbóli előrenyomulásának kedvezne, de az említett években mégsem közelítette meg a hínárosok területe a hatvanas években is jellemző bőséget.
A vízpartot szegélyező nádas társulások a tavak vízminőségének alakításában fontos szerepet töltenek be a felületükön megtapadó élőbevonat szűrő funkciója által. A vízszintcsökkenés e vegetációra nem feltétlenül hat negatívan. A Balatonon a nádas pusztulása egyre nagyobb mértéket öltő folyamat, azonban az alacsony vízszintű, aszályos években a nádasok lokális terjedései voltak megfigyelhetők.


Pusztuló balatoni nádas – avasodás és babásodás (fotó: Sipkay Csaba)
Ahol a nádas partszakaszok csak keskeny sávban szegélyezik a Balaton partját, ott a jelentős vízszintcsökkenés hatására akár teljesen el is fogyhat alóluk a víz, így a szűrő funkciót sem tudják tovább betölteni.

Kiszáradt balatoni partszakasz Badacsonylábdihegynél, az aszály mélypontját jelentő 2003. évben. Az egykori partvonalat a baloldalon látható kőfal jelzi. (fotó: Sipkay Csaba)
A vízminőség szempontjából viszont a döntő kérdés az, hogyan érinti mindez az algavegetációt. Turisztikai szempontból legjelentősebbnek tekinthető vizünk, a Balaton vízminőségét ugyanis a mikroszkopikus algák túlzott mértékű elszaporodása veszélyezteti. A több mint 2000 balatoni algafaj túlnyomó része aljzathoz kötötten él (azaz bentikus szervezet), csupán egynegyedük folytat nyílt vízi, lebegő (planktonikus) életmódot. Ezek közül is csak tíznél kevesebb faj képes adott körülmények között tömegesen elszaporodni, vízvirágzást okozni.
Az algák elszaporodása különösen a nyári hónapokban jelent nagy problémát, egyrészt mert ekkor a leginkább algás a víz, másrészt mert a kékmoszatok (cianobaktériumok) ilyenkor a legtömegesebbek, amelyek az édesvízi algák közül az egyedüli toxintermelők. Közülük 1982 óta a Balaton nyári alga-együtteseiben egy cianobaktérium faj, a Cylindrospermopsis raciborskii a legtömegesebb. A cianobaktérium toxinok az emberi szervezetre is veszélyesek lehetnek. A vízminőség romlása vagy a víz túlzott felmelegedése halpusztulásokhoz is vezethet.

Halpusztulás (fotó: Sipkay Csaba.)
Cylindrospermopsis raciborskii, a Balaton vízvirágzását okozó egyik kékalga faj (forrás: http://members.shaw.ca)
Súlyosan aszályos időszak már a közelmúltban is okozott gondot tavainkon. A Balaton vízgyűjtőjét 2000 és 2003 között súlyos szárazság sújtotta. A vízszint majd 70 centimétert süllyedt, ami az elmúlt ötven év legalacsonyabb vízállásaihoz vezetett. A változás különösen a déli parti, sekély zónában volt szembeötlő, ahol nagy kiterjedésű iszapos területek kerültek szárazra.
Folyóvizek
Mivel a folyóvizek általában jól átkeverednek mozgásuk során, esetükben a felmelegedés hatása egyszerű: növekszik a víz hőmérséklete. Mésrészt, a csapadék eloszlásának változásával az áradások intenzitása is növekedhet (Meyer et al. 1999, Perkins et al. 2010). A hideg égövi folyók vízjárása a felmelegedéssel meg fog változni, elsősorban az olvadás idejének és intenzitásának megváltozása miatt, a jégmentes időszak pedig meghosszabbodik. A zavarások szélsőértékei gyakran fontosabbak az ökoszisztémák szempontjából, mint az éves átlagértékek. Az Arktisz területein az éves csapadék mennyisége az elmúlt 100 évben 8 %-os növekedést mutatott. Más kontinenseken, ahol csökken a csapadék, az állandó vízfolyások időszekosakká változhatnak, ezáltal az ott élő közösség összetétele gyökeresen megváltozhat (Carpenter et al. 1992, Durand et al. 2009).
A csapadék és a vízjárás változását sokkal kevésbé tudjuk előre jelezni, pedig a folyóvizek szempontjából ezek alapvető tényezők, különösen az áradások ideje, erőssége és gyakorisága. Észak-Amerika dél-nyugati területein várhatóan 10 %-kal csökkenni fog, míg észak-nyugati területein 15 %-kal növekedni fog az éves csapadék a 21. század végéig. A kontinens többi területén nem várható változás az éves összegben, az eloszlásban viszont igen. Például Maryland területén a tavaszi áradások és a nyári szárazságok várhatóan gyakoribbak lesznek. Az elmúlt 50-90 évben, az északi 44o szélességtől északra eső folyókon a tavaszi áradás egyre korábban jelentkezett. Az alacsony vízhozam és a melegebb víz együttes hatása számos halfaj számára kedvezőtlen (Palmer et al. 2009). A folyók vízhőmérséklet és oxigéntartalom által meghatározott hal zónái eltolódhatnak a klímaváltozás hatására (Carpenter et al. 1992, Sipkay et al. 2009). A torkolatoknál a tengervíz folyókba történő feláramlása fokozódhat, a tengerek emelkedő vízszintja miatt.
A Duna-medencében az elmúlt 30 évben határozottá vált felmelegedés hatással volt a folyóvizek hőmérsékletére is, így az ott bekövetkezett ökológiai változások feltehetően összefüggésben állnak a felmelegedéssel. Ilyen a Duna és vízgyűjtőjén megfigyelhető invazív ponto-kaszpikus halfajok terjedése is, amelyek a Fekete-tenger vidékéről a Duna vízrendszerén haladva kerültek a kontinens középső részére. Az 1970-es évektől számos gébfaj terjedését regisztrálták, melyek elterjedési területe jelenleg is gyors ütemben nő. Legrégebben a tarka géb (Proterorhinus marmoratus) és a folyami géb (Neogobius fluviatilis) terjedése kezdődött meg a folyók alsó szakaszairól a felső szakaszok felé, az utóbbi 15 évben pedig újabb négy gébfaj indult meg fölfelé a Dunán. A sorozatos esetek határozott összefüggést mutatnak a globális felmelegedéssel. Ennek alapján várható, hogy a következő évtizedekben újabb melegigényes halfajok települnek be a Fekete-tenger vidékéről Közép-Európába, újabb változásokat okozva a folyószakaszok halközösségeiben.

A folyami géb (Neogobius fluviatilis) egyike a napjainkig is terjeszkedő invazív fajoknak. A Balatonban is megjelent és gyakorivá vált. (forrás: www.hik.hu)
Vizes élőhelyek
Magyarországon a folyószabályozások és lecsapolások előtt a vizes területek aránya sokkal nagyobb volt a jelenleginél. A XX. század második felében világszerte felgyorsult a vizes területek pusztulásának üteme, ez eredményezte azt a nemzetközi összefogást, mely a vizes élőhelyek védelméről szóló Ramsari Egyezmény létrehozásához vezetett. Jelenleg 23 hazai vizes élőhely található a Ramsari Jegyzéken, összesen 180 000 hektár kiterjedéssel.
A Ramsari Jegyzék 23 hazai vizes területe (forrás: www.ramsar.hu)
Eredetileg a rohamosan csökkenő vízimadár állományoknak kívántak a csatlakozó országok védelmet biztosítani. A tapasztalatok azonban hamar rávilágítottak arra a tényre, hogy önmagában az élőhelyek védelme nem elegendő, magát az ökológiai rendszert kell megőrizni, amely képes az ott előforduló fajok eltartására. A vizes élőhelyeknek – „wetland”-eknek – igen fontos szerepük van a föld biodiverzitásának fenntartásában. A vizes területekre a globális felmelegedés sok esetben igen nagy veszélyt jelent. Számos védett állatfaj kipusztulását okozhatja ezen élőhelyek további degradációja vagy teljes kiszáradása.
A hazánkban endemikus fajok veszélyeztetettsége is fokozódhat, ilyen például az egykor tömeges halfaj, a lápi póc (Umbra krameri). Jellemzően hűvös, tiszta vizű mocsarak, tőzeggödrök, növényzettel dúsan benőtt alföldi tavak lakója. Az egykori kiterjedt mocsári és lápi környezetben olyannyira tömeges volt, hogy disznóhízlalásra is használták. Napjainkra, elsősorban az élőhelyének számító területek megszűnésével vagy beszűkülésével, állománya jelentősen megcsappant, a faj a kipusztulás közvetlen veszélyébe került. 1974 óta védett faj.

A lápi póc (Umbra krameri) fő elterjedési területét a Kárpát-medence alkotja. (forrás: www.ittiofauna.org)
Lassú kolonizációs képességük és vízhez kötött életmódjuk miatt a kétéltűek a klímaváltozás által leginkább veszélyeztetett élőlénycsoportok közé tartoznak. Bár a fajok nagy részének egyedszáma normális körülmények között is ciklikusan változik, több vizsgálat is kimutatta a kétéltűek megfogyatkozása és a klímaváltozás közötti összefüggést. A szaporodóhelyek egyre hosszabb időre történő kiszáradása és a hosszú aszályos időszakok rendkívül megnehezítik a kétéltűek túlélését. Hazánkban minden kétéltű védelem alatt áll, de kipusztulásuk a következő 25 évben nem várható. Azonban ismertek kis hazai populációk, amelyek túlélését a klímaváltozás alapvetően befolyásolja. Ilyen a legkisebb hazai elterjedésű faj, az alpesi tarajos gőte (Triturus carnifex).

Hazánkban az alpesi tarajos gőte (Triturus carnifex) különösen veszélyeztetett. (forrás: wdfw.wa.gov)
A Balatont tápláló kisvízfolyások számos megfogyatkozott halfaj refúgium („menedék”) területéül szolgálnak, így elapadásuk komoly természetvédelmi veszteséget jelenthet.

Egervíz, Balatonfelvidéki Nemzeti Park. (Fotó: Sipkay Csaba.)
Lápok
A vizes élőhelyek különösen értékes és fontos típusai a lápok. A lápok az ökológiai szempontból kiemelkedően fontos vizes élőhelyeknek a biológiai sokféleség megőrzése szempontjából legfontosabb csoportjába tartoznak. A lápok még a nagy lecsapolások előtti időszakban is hazánk területének mindössze 1,1%-át tették ki. Az európai kontinensen az egykori kb. 495 ezer négyzetkilométernyi lápvidék néhány évtized alatt 187 ezer négyzetkilométerre zsugorodott. Ez az európai átlagban is hatalmas (mintegy 62%-os) veszteség hazánkban még drámaibb arányokat mutat, hiszen hazánk lápterületeinek több mint 97%-a odaveszett.

Égeres láperdő (Carici elongatae-Alnetum) az égerlábakon gazdag páfrány- és mohaszinttel tarajos pajzsikával (Dryopteris cristata) és tőzegmohákkal a Darányi Púpos erdőben (forrás: www.hik.hu)
A lápok vízszintje (természetes állapotában) nagyfokú állandóságot mutat, és a víz felszíne alatt oxigéntől elzárt (anaerob) viszonyokat teremt. Ezért a lápok az egyéb vizes élőhelyektől (pl. a mocsaraktól) főként abban különböznek, hogy bennük az elhalt növényi anyagok nem bomlanak le, hanem tőzeget képezve felhalmozódnak, így szenet vonnak ki a bio-geokémiai ciklusokból. Ennek ökológiai jelentősége azért óriási, mert a légkörből kivont szén-dioxid a legfontosabb üvegházhatású gáz, ami Földünk klímájának alakulásában meghatározó. A tőzegképződés a szénképződés első lépése.

Éger-kőris láperdő (Fraxino pannonicae-Alnetum) békaliliomos nyílt vizes típusa békaliliommal (Hottonia palustris) Dabasnál .
A tőzeg porózus szerkezete és kémiai tulajdonságai révén nemcsak szén-rezervoár, hanem duzzadóképessége folytán nagyon sok vizet is képes megkötni, így meghatározó szerepe van a vízviszonyok szabályozásában és a csapadékvíz továbbözönlését megakadályozó vízvisszatartásban.
A lápok élővilág-védelmi jelentőségét azonban nemcsak ökológiai szerepük, hanem döntően a biológiai sokféleség megőrzésében való jelentőségük adja. A lápokra jellemző élőhelyi sokféleség és térbeli heterogenitás számos ritka, különleges élőlény fennmaradását biztosítja. A lápok élővilágában sok esetben fedeztek fel olyan fajokat, amelyek régmúlt idők, máshol már kihalt tanúi, ilyenek például hazánkban a lápokhoz kötődő jégkori reliktum fajok, amelyek csak a speciális lápi körülmények között maradhattak fenn. A kis foltokban, hosszú ideig elzártan megőrződő populációkban fajképződési folyamatok is történnek, ennek folyamán bennszülött lokális fajok, endemizmusok alakulnak ki. Ezen reliktum és endemikus fajok megőrzése gyakran egy egészen kis lápfolt megmaradásán múlik, hiszen esetleg a világon sehol máshol nem fordulnak elő.

Szibériai nőszirom (Iris sibirica, Iridaceae) (forrás: picasaweb)
A tőzegképződéssel összefüggésben a lápok nemcsak saját élővilágukról hordoznak információt, hanem a születésüket követő földtörténeti és kultúrtörténeti tényekről, korszakokról is árulkodnak. A lápok időrendi rétegekben megőrzik (fosszilizálják) a tágabb környékükről behulló virágporszemeket, növényi és állati maradványokat, vagy a történeti korokban a lápba menekült emberek nyomait és tárgyait is. A tőzegrétegekben sok ezer évre visszamenőleg megőrzött „feljegyzések” kiolvasása olyan tudományos információkat ad számunkra, amelyek semmilyen más módszerrel nem szerezhetők meg. Ezért is fontos, hogy ezek a „könyvtárak” ne semmisüljenek meg a tudományos feldolgozásukat megelőzően.
A klímaváltozás hatása az édesvízi közösségekre
A klíma utóbbi évtizedekben megfigyelt változásai, melegedése és a vízi táplálékhálózatok összefüggéseivel foglalkozó munkák (Schindler et al. 1990, Livingstone 2003, Straile et al. 2003) elengedhetetlenül fontosak a várható felmelegedés lehetséges hatásainak feltérképezéséhez. Elsősorban tavak planktonikus közösségeinek változásai esetén mutattak ki egyértelmű összefüggéseket a már megfigyelt felmelegedéssel, más környezeti tényezők – mint tápanyagterhelés változásai – mellett (Annaville et al. 2002; 2007; Molinero et al. 2006). Gyllsrtröm et al. (2008) európai sekély tavakban mutatta ki a klíma központi szabályozó szerepét a zooplankton közösség formálásában, 81 tó adatainak részletes feldolgozásával. A klímától való függés legerősebben a pelágikus plankton esetén jelentkezik, a bentikus és perifitikus taxonok legfőképp a makrofiton borítás által befolyásoltak. A Szerzők szerint a klíma – a teljes foszfor koncentráció után – a zooplankton biomassza második legfontosabb indikátora. A vízhőmérséklet és a zooplankton denzitás korrelációja gyakori jelenség (pl. Carvalho & Kirika 2003, Kobayashi et al. 1998, Vadadi-Fülöp et al. 2009a). Mindez persze nem jelenti azt, hogy lineáris kapcsolatot kellene feltételeznünk a hőmérséklet és a denzitás közt, azonban arra mindenképpen felhívja a figyelmet, hogy a vízhőmérséklet igen fontos tényező a zooplankton dinamikájának alakításában.
Bizonyos tanulmányok a klimatikus hatások specifikus vonatkozásait domborítják ki, mint amilyen a téli jégborítás időtartama vagy a tavaszi felkeveredés mértéke (Rolinski et al. 2007), mások általánosabban a hőmérséklet hatásait helyezik előtérbe (Wagner & Benndorf 2006). Tavak esetén, a klímaváltozással kapcsolatban további jellemző kutatási irányok a vízhőmérséklet változásán túl a jégborítás időtartamának, a tavaszi fitoplankton csúcsprodukciónak, a tiszta víz fázisnak, a hal abundanciának és a préda-predátor interakcióknak változásait vizsgálni (Magnuson et al. 1990; Schindler et al. 1990; Scheffer et al. 2001; Winder & Schindler 2004; Blenckner 2008; Mooij et al. 2005).
A klíma melegedése többféle módon hathat a vízi táplálékhálózatokra. Okozhatja a szukcesszionális stádiumok időzítésének és időtartamának megváltozását (Straile 2005), de okozhatja a táplálékhálózat struktúrájának módosulását is, a különböző szukcesszionális stádiumokban (Wehenmeyer et al. 1999). Továbbá az egyes fajok életmenetében is változások történhetnek: például a hosszú életű fajok reprodukciós időszakának időzítése megváltozhat, vagy a Copepoda fajok metamorfózisának időzítése, a diapauza kezdetének és végének időbeli elcsúszása az egész táplálékhálózat struktúrájában változást, elmozdulást okozhat (Straile 2005).
A vizek gyorsabb és drasztikusabb felmelegedése értelemszerűen a fitoplankton tömegprodukció korábbi megjelenését hozhatja magával. Több tanulmány is korábbi maximumokat prediktál az alga biomasszában, amely a biomassza növekedésével jár együtt (Flanagan et al. 2003), különösen a téli félévben (Thackeray et al. 2008). Az invazív cianobaktériumok esetén is – mint amilyen a vízvirágzásokban gyakorta központi szerepet játszó Cylindrospermopsis raciborskii – az időzítés megváltozása rendszerint a korábbi megjelenés irányába mutat (Wiedner et al. 2007).
Annak következtében, hogy a tavak táplálékhálózatában igen erős szezonális dinamika mutatkozik, a klíma hatása erősen szezonspecifikus. Ezért nem szabad elhanyagolni a kutatásokban az alacsonyabb biológiai aktivitás miatt kevesebb teret kapott téli félév eseményeit sem, amelyek a mérsékelt övi tavakban különös jelentőséggel bírnak. A XX. században észlelt felmelegedés ugyanis erősen megnyilvánult a téli félév meteorológiai jelenségeiben. Erre a tavak fizikailag érzékenyen reagálnak. Változik a jéggel borított időszak hossza (Adrian et al. 1999, Weyhenmeyer 1999), de – ezzel kapcsolatban – változik a téli, szél általi felkeveredések intenzitása és időzítése is (Geadke et al. 1998), amely a fitoplankton tavaszi tömeggyarapodásának formációjára erős hatással van.
A téli időszakban a felkeveredési periódusnak alapvető szerepe van a később kialakuló fitoplankton csúcsprodukció lefutására, ezért e periódus vizsgálata alapvető jelentőségű a klíma megváltozásával kapcsolatos kutatásokban. A felkeveredési periódus („mixing period”) az óceánok és mély tavak esetében a terméketlen, sivár földek vízi analógiái (Reynolds 1997). A téli felkeveredési periódusban a primer produkció limitált egyrészt az alacsony hőmérséklet, továbbá a beeső sugárzás éves minimuma és a vízfelszínről való visszaverődés éves maximuma révén. Amint ezek a feltételek az év során változni kezdenek (növekvő hőmérséklet, a napsugárzás növekvő beesési szöge, stb.) a fitoplankton produkció növekedésnek indul. Ennél fogva fontos feladat a fitoplankton virágzás megindításának folyamatát megérteni és prediktálni, így a klímaváltozás (és más környezeti változások) várható irányairól is jelentős információhoz juthatunk (Peeters et al. 2007). Dunai mellékágakban, holtágakban télen, jég alatt is kialakulhat nagy abundanciájú fitoplankton, melyben hidegtűrő Centrales és Cryptophyta, Volvocales fajok szaporodhatnak el (Kiss & Genkal 1993).
A kérdéskör vizsgálatában a tavi rendszerek között a sekély tavak számos munkában kiemelt szerephez jutnak, mert direktebb módon reagálnak a változó időjárási állapotokra, mint a mélyebb víztesttel rendelkezők (Gerten & Adrian 2001). Esetükben a víz átlátszósága alapvető tényező. Ezzel összefüggésben és az alternatív stabil állapotok koncepciójának elfogadásával (Scheffer et al. 1993) beszélhetünk a makrofiton dominanciájával jellemezhető tiszta víz fázisról és a fitoplankton által dominált turbid fázisról. A két fázis között váltás lehetséges a külső tápanyagterhelés kritikus szint felé emelkedésével. De a fitoplankton uralta tavak bizonyos időszakában is megjelenhet a tiszta víz fázis, jellemzően a tavasz végén, a zooplankton általi fitoplankton fogyasztás fokozódása miatt (Gulati et al. 1982; Sommer et al. 1986). A klímaváltozás feltételezhetően negatívan befolyásolja majd a sekély tavak áttetszőségét: destabilizálja a makrofiton uralta tiszta állapotot és stabilizálja a fitoplankton uralta turbid állapotot (Mooij et al. 2005). Ezen alapvetően negatív hatást (amelyet hollandiai sekély tavak esetén demonstráltak) számos tényező alapján valószínűsítik a kutatók. A téli csapadék növekedése és csapadékhullás extrém eseményei a tavak P-terhelésének növekedését okozzák (Mooij et al. 2005). A hőmérséklet emelkedése belső tápanyag emelkedést okoz (Jensen & Andersen 1992; Liikanen et al. 2002).
Ezen állítások önmagukban is az eutrofizáció erősödésének fokozott veszélyét valószínűsítik. Ezek mellett a felmelegedés további, egymásból következő folyamatokat indíthat be. Számos szerző szerint a magas hőmérséklet a cianobaktériumoknak különösen kedvez, amelyek kevésbé hatékony tápanyagot jelentenek a zooplankton számára (Dawidowicz et al. 1998; Gliwicz & Lampert 1990). A halak zooplankton fogyasztása ugyanakkor növekedhet, a halak téli mortalitásának csökkenésével (Mooij 1996; Mehner et al. 1995; Mooij & Van Nes 1998; Nyberg et al. 2001). Az alacsonyabb tavaszi zooplankton növekedés miatt a legelők kisebb nyomást jelentenek a fitoplanktonra, amely – a magas hőmérséklet mellett – ugyancsak a fitoplankton tavaszi növekedésének serkentése irányában hatnak. A kiülepedett tápanyagok visszaoldódásának („sediment resuspension”) szél általi növekedése várható (Schelske et al. 1995). Mindezek a megállapítások elsősorban hollandiai sekély tavak esetein alapulnak, de hasonló megállapításokra jutott Jeppensen et al. (1990) is, dániai sekély tavak vizsgálata alapján. Eredményeik szerint a klímaváltozás az eutrofizáció hatását „utánozza”.
A folyókban a különféle halegyüttesekkel jellemezhető szinttájak – mint pisztráng, pénzes pér, márna és dévérkeszeg szinttájak – szempontjából is érdekes kérdés a klímaváltozás. A folyók és szakaszainak bizonyos „hal zónákkal” való jellemzése nagy múltra tekint vissza (Fritsch 1872). Thienemann (1925) különített el eleinte hat zónát („szinttájat”) és Huet (1949) tett kísérletet először ezeket a zónákat abiotikus tényezőkkel összefüggésbe hozni, mint amilyen a víz esése és a folyó mélysége. A legfontosabb környezeti paraméternek a folyó hossziránya mentén kialakult halegyüttesek, és így a szinttájak kialakítása szempontjából a hőmérséklet tekinthető (Flebbe et al. 2006; Pont et al. 2006). Így a vizek melegedése e szinttájak átrendeződését, elcsúszását okozhatja. A jelenleg megfigyelhető biogeográfiai korlátozó tényezők figyelembevételével már tettek kísérletet halegyüttesek eloszlásának várható hőmérsékletemelkedés hatására bekövetkező megváltozását megjósolni (Eaton & Scheller 1996; Rahel 2002).
A jövőben viszont a jelenleginél is drasztikusabb felmelegedés valószínűsíthető, amely olyan változásokat is generálhat vízi rendszerekben, amelyeknek talán még jelei sem fedezhetők fel az utóbbi évtizedekben tapasztalt melegedés során. A téma jelentőségét mutatja O'Reilly et al. (2003) Tanganyika tavon végzett kutatásai, miszerint a klímaváltozás negatív hatása jelentősebb lehet a lokális antropogén aktivitás vagy a túlhalászás hatásainál is.
Irodalomjegyzék
Adrian, R., Deneke, R., Mischke, U., Stellmacher, R., Lederer, P. (1995): A long-term study of the Heilingensee (1975–1992). Evidence for effects of climatic change on the dynamics of eutrophied lake ecosystems. – Archiv fur Hydrobiol 133: 315–337.
Atkinson A, Siegel V, Pakhomov EA, Rothery P (2004) Longterm decline in krill stock and increase in salps within the Southern Ocean. Nature 432:100–103
Babaluk, J.A., Reust, J.D., Johnson, J.D., and Johnson, L. 2000. First records of sockeye (Oncorhynchus nerka) and pink salmon (O. gorbuscha) from Banks Island and other records of Pacific salmon in Northwest Territories, Canada. Arctic 53(2):161–164.
Baltz, D.M., Moyle, P.B. (1993): Invasion resistance to introduced species by a native assemblage of California stream fishes. – Ecol Appl 3: 246–255.
Barbraud, Christophe & Henri Weimerskirch (2001): Emperor penguins and climate change Nature 411
Battarbee, Richard W. (2000): Palaeolimnological approaches to climate change, with special regard to the biological record - Quaternary Science Reviews 19 (2000) 107-124
Beaugrand, G. & Ibanez, F. 2004. Monitoring marine plankton ecosystems. II: Long-term changes in North Sea calanoid copepods in relation to hydro-climatic variability. Marine Ecology-Progress Series 284: 35-47.
Beisner, B.E., McCauley, E. & Wrona, F.J. (1996) Temperature-mediated dynamics of planktonic food chains: the effect of an invertebrate carnivore. Freshwater Biology 35, 219–232.
Beisner, B.E., McCauley, E. & Wrona, F.J. (1997) The influence of temperature and food-chain length on plankton predator–prey dynamics. Canadian Journal of Fisheries and Aquatic Sciences
Blenckner, T., Omstedt, A., Rummukainen, M. (2002): A Swedish case study of contemporary and possible future consequences of climate change on lake function. – Aquatic Sciences 64(2): 171-184.
Blenckner, T., Omstedt, A., Rummukainen, M. (2002): A Swedish case study of contemporary and possible future consequences of climate change on lake function. – Aquatic Sciences 64(2): 171-184.
Canadell, J. G., Le Quéré, C., Raupach, M. R., Field, C. B., Buitenhuis, E. T., Ciais, P., Conway, T. J., Gillett, N. P., Houghton, R. A., Marland, G. (2007): Contributions to accelerating atmospheric CO2 growth from economic activity, carbon intensity, and efficiency of natural sinks, Proceedings of the National Academy of Sciences of the United States of America 104 (47): 18866-18870.
Carpenther, S.R., Fisher, S.G., Grimm, N.B., Kitchell, J.F. (1992): Global change and the freshwater ecosystems. – Annual Reviews of Ecological Systems 23: 119-139.
Carvalho, L. & Kirika, A. 2003. Changes in shallow lake functioning: response to climate change and nutrient reduction. Hydrobiologia 506 (1-3): 789-796.
Clarke, R. (1994): The pollution of lakes and reservoirs, UNEP environment library, United Nation Environmental Program, Nairobi, Kenya.
Daufresne, M., Lengfellner, K., Sommer, U. 2009. Global warming benefits the small in aquatic ecosystems. Proceedings of the National Academy of Sciences of the United States of America 106 (31): 12788-12793.
Dawidowicz, P., Gliwicz Z.M., Gulati, R.D. (1988): Can Daphnia prevent a blue-green algal bloom in hypertrophic lakes? A laboratory test. – Limnologica (Berlin) 19: 21–26.
Eaton, J.G., Scheller, R.M. (1996): Effects of climate warming on fish thermal habitat in streams of the United States. – Limnol. Oceanogr. (41): 1109–1115.
Ficke, A.D., Myrick, C.A., Hansen, L.J. (2007): Potential impacts of global climate change on freshwater fisheries. – Rev. Fish. Biol. Fisheries 17: 581-613.
Flanagan, K. M., E. McCauley, F. Wrona & T. Prowse, 2003. Climate change: the potential for latitudinal effects on algal biomass in aquatic ecosystems. Canadian Journal of Fisheries and Aquatic Sciences 60: 635–639.
Fritsch A.J. (1872): Die Wirbeltiere Böhmens. Ein Verzeichnis aller bisher in Böhmen beobachteten Säugetiere, Vögel, Amphibien und Fische. – Arch Naturwissensch Landesdurchforsch Böhmen 2: 1-152.
Geadke, U., Straile, D., Pahl-Wostl, C. (1998): Trophic structure and carbon flow dynamics in the pelagic community of a large lake. – In: Polis, G.A., Winemiller, K.O. (eds), Food Webs Integration of Pattern and Dynamics. Chapmann and Hall, pp. 60-71.
Giller, P. S., Hillebrand, H., Berninger, U.-G. et al. 2004. Biodiversity effects on ecosystem functioning: emerging issues and their experimental test in aquatic environments. -/ Oikos 104: 423-436.
Hobbie Erik A. , Stephen A. Macko Herman H. Shugart (1999): Interpretation of nitrogen isotope signatures using the NIFTE model - Oecologia (1999) 120:405-415
Hoegh-Guldberg, O., P. J. Mumby, A. J. Hooten, R. S. Steneck, P. Greenfield, E. Gomez, C. D. Harvell, P. F. Sale, A. J. Edwards, K. Caldeira, N. Knowlton, C. M. Eakin, R. Iglesias-Prieto, N. Muthiga, R. H. Bradbury, A. Dubi, M. E. Hatziolos (2007): Coral
Reefs Under Rapid Climate Change and Ocean Acidification - Science 318, 1737; doi: 10.1126/science.1152509
Hoegh-Guldberg, O. and J.F. Bruno. 2010. Impacts of climate change on the world’s marine ecosystems. Science 328:1523-1528
Holzapfel, A. M. & Vinebrooke, R. D. 2005. Environmental warming increases invasion potential of alpine lake communities by imported species. Global Change Biology 11 (11): 2009-2015.
Jansen, W., and R.H. Hesslein. 2004. Potential effects of climate warming on fish habitats in temperate zone lakes with special reference to Lake 239 of the experimental lakes area (ELA), north-western Ontario. Environ. Biol. Fishes 70: 1-22.
Jeppesen, E., Kronvang, B., Meerhoff, M., et al. (2009) Climate change effects on runoff, catchment phosphorus loading and lake ecological state, and potential adaptations. Journal of Environmental Quality, 48, 1930–1941.
Kiss, K.T., Ács, É., Szabó, K.É. (2007): Algák és anyagforgalmi kapcsolataik. pp. 33-49. – In: Nosek J., Oertel N. (szerk.): „A Dunának, mely múlt, jelen s jövendő…”. 50 éves az MTA Magyar Dunakutató Állomása (1957-2007). Szemelvények az Állomás tudományos eredményeiből. MTA ÖBKI – MDÁ, Göd – Vácrátót
Klapper, H. (1991): Control of eutrophication in Inland waters. – Ellis Horwood Ltd., West Sussex, UK.
Livingstone, D.M. (2003): Impact of Secular climate change ont he thermal structure of a large temperate central european lake. – Climatic Change 57: 205-225.
Lofgren, B.M. (2002): Global warming influences on water levels, ice, and chemical and biological cycles in lakes: some examples. – In: McGinn NA (ed) Fisheries in a changing climate. American Fisheries Society, Bethesda, MD, pp. 15-22.
Lynch, Michael. 1978. Complex Interactions between Natural Coexploiters--Daphnia and Ceriodaphnia. Ecology 59:552–564.
MacLeod, J.C., Pessah, E. (1973): Temperature effects on mercury accumulation,toxicity, and metabolic rate in rainbow trout (Salmo gairdneri). – J. Fisher Res Board Can 30: 485-492.
Magnuson, J. J., L. B. Crowder, and P. A. Medvick. (1979): Temperature as an ecological resource. Am. Zool. 19: 33 l-343
Magnuson, J.J. (2002.a): Future of adapting to climate change and variability. – In: McGinn NA (ed) Fisheries in a changing climate. American Fisheries Society, Bethesda, MD, pp. 283-287.
Matthews, W.J., Marsh-Matthews, E. (2003): Effects of drought on fish across axes of space, time and ecological complexity. – Freshwater Biol 48: 1232-1253.
McDonald, J.H., B.C. Verrelli and L.B. Geyer. 1996. Lack of geographic variation in anonymous nuclear polymorphisms in the American oyster, Crassostrea virginica. Molecular Biology and Evolution 13: 1114-1118.
Meerhoff, M., Fosalba, C., Bruzzone, C., Mazzeo, N., Noordoven, W. & Jeppesen, E. (2006): An experimental study of habitat choice by Daphnia: plants signal danger more than refuge in subtropical lakes. - Freshwater Biology 51: 1320-1330.
Michelutti N, Wolfe AP, Vinebrooke RD, Rivard B, Briner J (2005) Recent primary production increases in arctic lakes. Geophys Res Lett 32:L19715.
Mokany K, Richardson AJ, Poloczanska ES, Ferrier S, The CSIRO CAF Biodiversity Working Group. 2010. Uniting marine and terrestrial modelling of biodiversity under climate change. Trends in Ecology and Evolution. 25: 550-551.
Montoya JM, Raffaelli D. (2010): Climate change, biotic interactions and ecosystem services - Philos Trans R Soc Lond B Biol Sci. 2010 Jul 12;365(1549):2013-8.
Mooij, W. M., Domis, L. N. D., Janse, J. H. 2009. Linking species- and ecosystem-level impacts of climate change in lakes with a complex and a minimal model. Ecological Modelling 220 (21): 3011-3020.
Moss B, McKee D, Atkinson D, Collings SE, Eaton JW, Gill AB, Hatton HK, Heyes T and Wilson D (2003) How important is climate? Effects of waming, nutrient addition and fish on phytoplankton in shallow lake microcosms. J Appl Ecol 40: 782-792
Murty, A.S. (1986.a): Toxicity of pesticides to Fish. I. - II. CRC Press, Boca Raton, FL.
Nussey, G., van Vuren, J.H.J., du Preez, H.H. (1996): Acute toxicity of copper on juvenile Mozambique tilapia, Oreochromis mossambicus (Cichlidae), at different temperatures. – S Afr J Wildlife Res 26: 47-55.
O’Reilly, C.M., Alin, S.R., Plisnier, P.D., Cohen, A.S., McKee, B.A. (2003): Climate change decreases aquatic ecosystem productivity of Lake Tanganyika, Africa. – Nature 424: 766-768
Palmer, M. D. , S. A. Good, K. Haines, N. A. Rayner, P. A. Stott, (2009): A new perspective on warming of the global oceans GEOPHYSICAL RESEARCH LETTERS, VOL. 36, L20709, 5 PP., 2009 doi:10.1029/2009GL039491
Perkins DM, Mckie BG, Malmqvist B et al. (2010) . Environmental Warming and Biodiversity-Ecosystem Functioning in Freshwater Microcosms: Partitioning the Effects of Species Identity, Richness and Metabolism. ADV ECOL RES vol. 43, 177-209.
Petchey O. L., McPhearson P. T., Casey T. M., Morin P. J. 1999 Environmental warming alters food-web structure and ecosystem function. Nature 402, 69–72. (doi:10.1038/47023)
Petchey, O.L., Hector, A. & Gaston, K.J. (2004). How do different measures of functional diversity perform? Ecology, 85, 847–857.
Poff, N.L., Brinson, M.M., Day, J.W. (2002): Aquatic ecosystem & Climate change. Potential impacts on inland freshwater and coastal wetland ecosystems in the United States. – Pew Center on Global Climate Change. pp. 44.
Quinlan, R., Douglas, M.S.V., Smol, J.P. (2005): Food web changes in arctic ecosystems related to climate warming. – Global Change Biology 11(8): 1381-1386.
Rahel Frank J., Christopher J. Keleher, and Jefry L. Anderson (1996): Potential habitat loss and population fragmentation for cold water fish in the North Platte River drainage of the Rocky Mountains: Response to climate warming - Limnol. Oceanogr., 41(5), 1996, 1116-l 123.
Reynolds, C.S. (1997): Vegetation processes in the pelagic: A model for ecosystem theory. – Ecology Institute.
Richardson, A. J. 2008. In hot water: zooplankton and climate change. ICES Journal of Marine Science 65 (3): 279-295.
Rolinski, S., Horn, H., Petzoldt, T., Paul, L. (2007): Initifying cardinal dates in phytoplankton time series to enable the analysis of long-term trends. – Oecologia 153: 997-1008.
Schindler, D. E., D. E. Rogers, M. D. Scheuerell, and C. A. Abrey. 2005. Effects of changing climate on zooplankton and juvenile sockeye salmon growth in southwestern Alaska. Ecology 86:198- 209.
Schwartz Mark W, Louis R. Iverson, Anantha M. Prasad, Stephen N. Matthews & Raymond J. O’Connor et al. (2006): Predicting extinctions as a result of climate change - Ecology, 87(7), 2006, pp. 1611–1615
Sipkay Cs,.Kiss, K. T., Vadadi-Fülöp, Cs., Hufnagel, L. (2009b): Trends in research on the possible effects of climate change concerning aquatic ecosystems with special emphasis on the modelling approach. - Applied Ecology and Environmental Research 7(2): 171-198.
Sipkay, Cs Kiss K.T, Vadadi-Fülöp Cs, Homoródi R and L. Hufnagel (2012): Simulation modeling of phytoplankton dynamics in a large eutrophic river, Hungary — Danubian Phytoplankton Growth Model (DPGM) - Biologia(Bratislava) Section Botany, Volume 67, Number 2, 323-337, DOI: 10.2478/s11756-012-0004-2 (IF 2010: 0,609)
Sipkay Cs, Kiss, K. T., Vadadi-Fülöp, Cs., Hufnagel, L. (2009): Trends in research on the possible effects of climate change concerning aquatic ecosystems with special emphasis on the modelling approach. - Applied Ecology and Environmental Research 7(2): 171-198.
Sipkay, Cs., Horváth, L., Nosek, J., Oertel, N., Vadadi-Fülöp, Cs., Farkas, E., Drégelyi-Kiss, Á., Hufnagel, L. (2008): Analysis of climate change scenarios based on modelling of the seasonal dynamics of a Danubian copepod species - Applied Ecology and Environmental Research 6(4): 101-108
Straile, D. (2005): Food webs in lakes – seasonal dynamics and the impacts of climate variability. – In: Belgrano, A., Scharler, U.M., Dunne, J. & Ulanowicz, R.E. Straile, D., Livingstone, D.M., Weyhenmeyer, G.A., George, D.G. (2003): Complex effects of winter warming ont he physico-chemical characteristic of a deep lake.
Thackeray, S.J., Jones, I.D., Maberly, S.C. (2008): Long-term change in the phenology of spring phytoplankton: species-specific responses to nutrient enrichment and climatic change. – Journal of Ecology 96: 523-535.
Vadadi-Fülöp Cs., D. Türei, Cs. Sipkay, Cs. Verasztó, Á. Drégelyi-Kiss, L. Hufnagel (2009): Comparative Assessment of Climate Change Scenarios Based on Aquatic Food Web Modeling - Environmental Modeling and Assessment 14(5) : 563-576
Vadadi-Fülöp, Cs., Hufnagel, L., Sipkay, Cs., Verasztó, Cs. (2008): Evaluation of climate change scenarios based on aquatic food web modelling - Applied Ecology and Environmental Research 6(1):1-28.
Vadadi-Fülöp, Cs., Cs Sipkay , G. Meszaros , L. Hufnagel (2012): Climate change and freshwater zooplankton: what does it boil down to? - AQUATIC ECOLOGY 46(4): 501-519 DOI: 10.1007/ s10452-012-9418-8 Published: DEC 2012 (IF2011: 1,365)
Van Doorslaer W, Robby Stoks, Ine Swillen, Heidrun Feuchtmayr, David Atkinson, Brian Moss, Luc De Meester (2010): Experimental thermal microevolution in community-embedded Daphnia populations –Climate Research Vol. 43: 81–89, 2010 doi: 10.3354/cr00894
Van Doorslaer W, Stoks R, Duvivier C, Bednarska A, De Meester L (2009) Population dynamics determine genetic adaptation to temperature in Daphnia. Evolution 63: 1867–1878
Weyhenmeyer, G.A., Blenckner, T., Pettersson, K. (1999): Changes on the plankton spring outburst related to the North Atlantic Oscillation. – Limnology Oceanography 44: 1788-1792.
Woodward G, Perkins DM, Brown LE (2010) . Climate change and freshwater ecosystems: impacts across multiple levels of organization. PHILOS T R SOC B vol. 365, (1549) 2093-2106.
Wrona, F.J., T.D. Prowse, J.D. Reist, J.E. Hobbie, L.M.J. L´ evesque. & W.F. Vincent. 2006. Climate change effects on aquatic biota, ecosystem structure and function. - Ambio 35: 359–369.